Produktinformation
Auch verfügbar als maßgeschneidertes Produkt nach Ihren Bedürfnissen hergestellt!
OEM-Optionen:
Wenn Sie Materialien als Kit-Kontrollen oder als Drittanbieter-Kontrollen für die Validierung Ihrer Kits in Kundenlabors benötigen, kontaktieren Sie uns bitte über: sales@sens-id.com
Verwendung als vollständiges Workflow-Kontrollmaterial:
Um vollständige Workflow-Kontrollen mit diesem Produkt selbst herzustellen empfehlen wir die Verwendung unserer humanen DNA-freien Plasmaprodukte. Mischen Sie die cfDNA nach Bedarf mit dem DNA-freien Plasma, um Plasmamaterialien mit den erforderlichen DNA-Konzentrationen zu erhalten.

Wählen Sie Ihre Plasmavolumenoptionen:
- 5 ml human Plasma (human-tech) 1-fold concentrated
- 40 ml human Plasma (human-tech) 1-fold concentrated
- 1,000 ml human Plasma (human-tech) 1-fold concentrated
Diese Produkte sind in idealer Weise geeignet für digitale PCR und/oder Next Generation Sequencing (NGS). Insbesondere zur
– Validierung und Entwicklung von Sequenzierprotokollen (z.B. Amplicon Sequenzierung) und PCR-Protokollen
– zur Bestimmung der Nachweisgrenze der Methode
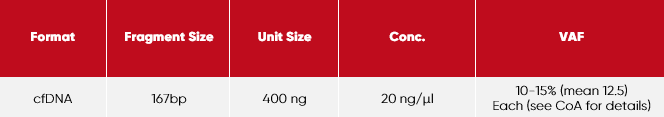
Dieses Produkt enthält den folgenden Satz separater Röhrchen:
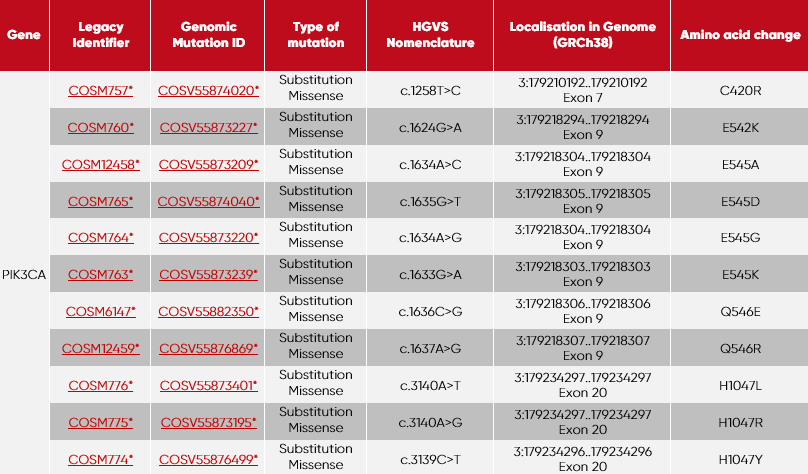
| Röhrchen | Mutationen pro Röhrchen |
| 1 | PIK3CA-C420R + PIK3CA-E545A |
| 2 | PIK3CA-Q546R + PIK3CA-E542K |
| 3 | PIK3CA-H1047L + PIK3CA-E545D |
| 4 | PIK3CA-H1047R + PIK3CA-E545G |
| 5 | PIK3CA-H1047Y + PIK3CA-E545K |
| 6 | PIK3CA-Q546E |
| 7 | inkl. Wildtype (Ashkenazim son cfDNA Cat. No.: SID-000003) |
Jedes Reaktionsgefäß weist die folgenden Merkmale auf:
Mutationen:
Puffer:
Tris-EDTA (10 mM Tris, 1 mM EDTA), pH 8,0
Lagerung:
2-8 °C
Haltbarkeit:
stabil bis 24 Monate nach Herstellungsdatum (wie geliefert)
Qualitätssicherung
Fragmentgrößenbestimmung:
Elektrophorese-Bioanalyzer-High Sensitivity DNA Kit Agilent
Allelfrequenz/Kopienzahl (metrologisch rückverfolgbar):
ddPCR (Bio-Rad)
Quantifizierung (metrologisch rückverfolgbar):
1. UV-Vis Spektrophotometrie (NIST-Referenzmethode) zur Messung der gesamt DNA
2. fluorometrische dsDNA Messung (QuBit)
Technischer Hintergrund
Ursprung:
The Genome In A Bottle (GIAB) cell line from the Personal Genome Project (PGB): GM24385 (HG002- NA24385 – huAA53E0)
Bioinformatik:
– Lot specific sequencing files: LOT Search
– High-confidence variant calls: ftp://ftp-trace.ncbi.nlm.nih.gov/giab/ftp/release/AshkenazimTrio
– Raw datasets and bam files, currently including 10X Genomics, BioNano, Complete Genomics regular and LFR, 300x Illumina paired-end, Illumina 6kb mate-pair, 1000x Ion exome, custom molecular libraries, ~0.05x Oxford Nanopore, and 70x/30x/30x PacBio: ftp://ftp-trace.ncbi.nlm.nih.gov/giab/ftp/data/AshkenazimTrio/HG002_NA24385_son/
*GRCh38 COSMICv90








